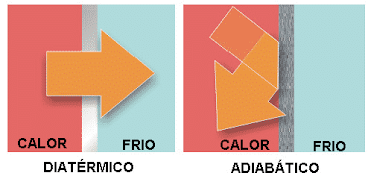
Experimento "Esta frió o caliente"

Material 3 recipientes medianos Tus manos Un poco de agua a temperatura ambiente Un poco de agua caliente que NO queme tus manos Un poco de agua fría Unos cubitos de hielo Una servilleta de papel o una toalla seca. Procedimiento Vierte en el primer recipiente el agua caliente que NO queme tus manos. En el segundo recipiente, vierte el agua fría con los cubitos de hielo. En el tercer recipiente vierte el agua a temperatura ambiente. Sumerge el dedo índice de una mano en el recipiente con agua fría, déjala un minuto, luego sácalo e introdúcelo el vaso con agua a temperatura ambiente.